





| 编号 | 30949 |
| 总例数 | 50例 |
| 性别例数 | 男32例,女18例 |
| 治疗组例数 | |
| 对照组例数 | |
| 年龄区间 | 40~86岁 |
| 平均年龄 | 69.2岁 |
| 疾病 | 脑梗塞 |
| 并发症 | 右基底核梗塞l8例,合并脑干梗塞2例;左基底节梗塞16例,合并脑干梗塞2例;双基底核梗塞lO例;皮层梗塞7例。50例中合并冠心病10例,其中5例合并房颤。 |
| 药品通用名称 | 巴曲酶注射液 |
| 药品商品名称 | |
| 药品英文名称 | Batroxobin Injection |
| 剂型 | 注射液 |
| 规格 | |
| 批准文号 | |
| 生产厂家 | |
| 分类 | 生物制品 |
| 用药目的 | 治疗 |
| 用法用量 | 治疗首日用DF-521 10BU 0.9%氯化钠注射液250ml静滴1h,以后隔日静滴5BU,用3次共20BU为一疗程,其中8例加用1次共25BU。 |
| 联合用药 | |
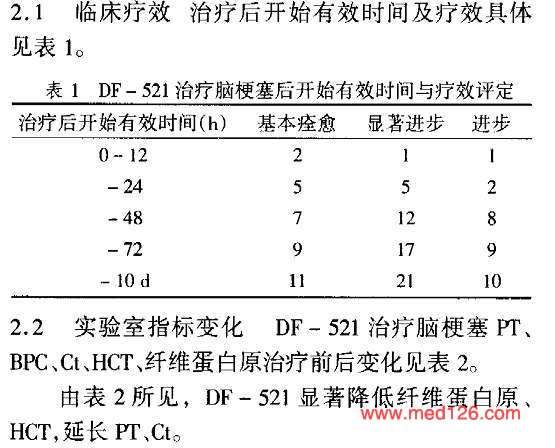
| 疗效评价标准 | 治疗前与治疗后10d,根据爱丁堡斯堪的那维亚评分法,结合患者生活状态评定。基本痊愈:神经功能损失总分减少90%,病残程度为0级;显著进步:神经功能损失总分减少46%~89%,病残程序1~3级;进步:神经功能损失总分减少18%~45%;无变化:神经功能损失总分增加18%或更多,包括死亡。 |
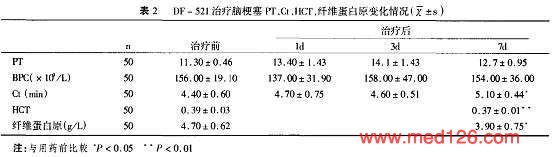
| 治疗效果及临床指征比较 |
  |
| 本研究报道不良反应 | 仅5例头,2例短暂鼻衄,1例解黑便,经处理后恢复正常。 |
| 其他报道不良反应 |